La révolution sonogénétique pourrait restaurer la vision grâce au son

Et s’il était possible, grâce à des ultrasons, de permettre aux aveugles de « voir » en activant directement les neurones de la partie de leur cerveau responsable de la vision ? Aussi incroyable qu’elle paraisse, cette question n’est pourtant plus du domaine de la science-fiction, grâce aux travaux d’une équipe de recherche internationale associant le laboratoire Physique pour la médecine (ESPCI Paris/PSL Université/Inserm/CNRS), l’Institut de la Vision (Sorbonne Université/Inserm/CNRS) à Paris et l’Institut d'ophtalmologie moléculaire et clinique de Bâle. Le point avec les directeurs de recherche Inserm, Mickaël Tanter et Serge Picaud, qui ont dirigé cette recherche.
"Devant la grande résolution de l’imagerie fonctionnelle ultrasonore du cerveau, il semblait réaliste de faire l’inverse, c’est-à-dire de projeter des images ultrasonores dans le cerveau, avec une très bonne résolution spatiale" Serge Picaud


En photo : à gauche, Serge Picaud, directeur de l'Institut de la Vision, Paris. // À droite, Mickaël Tanter, directeur de l'Institut de Physique et Technologies pour la santé de Paris à l'ESPCI PSL Paris
© Laurent Ardhuin / Sorbonne Université
Dans le monde, en 2020, 3,6 millions de personnes ont perdu la vue des suites d’un glaucome et 0,86 millions à cause d’une rétinopathie liée au diabète. Parce que ces pathologies impactent le nerf optique, les solutions thérapeutiques qui ciblent les photorécepteurs, ou les autres couches de la rétine, ne peuvent pas s’appliquer à la restauration de la vision chez ces patients. Il faut aller chercher plus en aval du système d’intégration de l’information visuelle, directement dans le cerveau, au niveau du cortex visuel. C’est ce que propose le projet SoundVision, actuellement en cours de financement, qui s’appuie sur des résultats révolutionnaires obtenus sur des souris, et acceptés pour publication début avril 2023.

© CNRS Images
Restauration de la vision : comment aller là où l'optogénétique ne pénètre pas
Avec ses collègues de l’institut de la Vision, Serge Picaud travaille depuis de nombreuses années sur des stratégies thérapeutiques de restauration de la vision basées sur des prothèses rétiniennes ou des approches optogénétiques, qui permettent de rendre d’autres cellules que les photorécepteurs sensibles à la lumière. C’est suite à ces travaux que, en 2016, lui et le Pr José-Alain Sahel sont approchés par un responsable de la DARPA (Defense Advanced Research Projects Agency) - une agence de recherche américaine pour les projets de recherche avancée de défense. Celui-ci s’interroge sur la restauration de la vue pour les militaires qui l’ont perdue au combat, souvent suite à des dégâts rétiniens irréversibles. « Il était très intéressé et convaincu que nous pouvions développer une stratégie pour cibler le cortex visuel, auquel le Pr Sahel et moi-même n'avions à l’époque jamais touché », se souvient Serge Picaud. Fin 2016, un financement conséquent leur est accordé pour explorer cette voie. Mais début 2017, Donald Trump accède à la présidence des Etats-Unis, et un certain nombre de priorités changent.
Avant la fin de cette année, leur budget est coupé. Mais les chercheurs sont lancés et, stimulés par le défi de s’attaquer à une nouvelle partie du système visuel, ne veulent pas s’en tenir là. Car si, au départ, ils envisagent une thérapie similaire à celle qu’ils ont développée sur la rétine, ils doivent rapidement se rendre à l’évidence que celle-ci ne sera pas facilement transposable au cortex. En effet, la lumière utilisée dans l’approche optogénétique traverse très mal les tissus cérébraux. « Avant de penser appliquer une telle thérapie à l’homme il fallait la tester sur des primates. Mais quand nous avons commencé à dessiner le système optique de stimulation nécessaire pour pallier cette problématique de pénétration de la lumière, il s’est révélé extrêmement complexe », explique le chercheur. Complexe, et risqué, car pour permettre à la lumière d’atteindre les zones à activer, le système auquel ils réfléchissent, implique de retirer la dure-mère, cette membrane épaisse qui fait partie des méninges et entoure le cerveau, le protégeant notamment des infections microbiennes. « Ceux qui font des recherches sur le cortex savent qu’enlever la dure-mère fait courir un risque élevé aux animaux, donc prévoir un tel système pour l’homme aurait fait courir le même risque aux patients », souligne encore Serge Picaud. L’option n’est donc pas envisageable et les chercheurs commencent à douter de pouvoir parvenir à activer directement les neurones du cortex visuel.
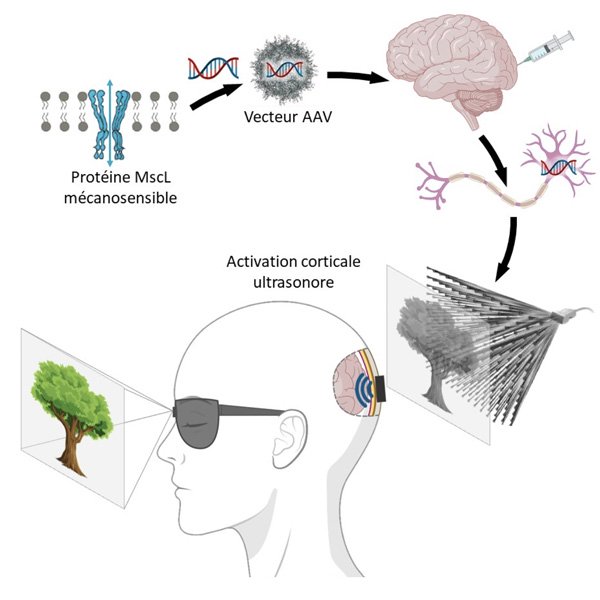
La thérapie sonogénétique consiste à modifier génétiquement certains neurones afin de pouvoir les activer à distance par des ultrasons.
© Alexandre Dizeux/Physics for Medicine Paris
Recherche en ophtalmologie, lorsque la physique s'en mêle
La solution viendra d’ailleurs. A cette période, José-Alain Sahel et Serge Picaud collaborent étroitement avec Mathias Fink et Mickaël Tanter, deux physiciens de l’ESPCI, spécialisés dans la physique des ondes en milieu complexe et leur application en imagerie et thérapie. Les Pr Sahel et Fink ont en effet obtenu en 2013 une bourse ERC Synergy, pour le projet Helmholtz, qui vise à codévelopper de nouvelles technologies d'imagerie non invasives pour l'ophtalmologie. Dans les années 2000, le Pr Mathias Fink et Mickaël Tanter ont développé une technique d’échographie ultrarapide, qui permet de prendre 10 000 images par seconde là où les échographies standards sont à 50 images. « Ce type d’échographie permet de voir l’intérieur du corps au ralenti, explique Mickaël Tanter, de capter la vibration de nos tissus, qui va nous donner directement accès à leur dureté. Or, la dureté, la rigidité, c’est le premier paramètre médical. Le premier acte médical, depuis toujours, c’est en général la palpation des organes, car de nombreuses pathologies modifient cette rigidité ». C’est notamment le cas des cancers.
Si le lien avec l’ophtalmologie et la récupération de la vision est encore loin à l’époque, il se précise dans les années 2010, quand les deux physiciens réalisent que leur technologie d’imagerie ultra-rapide leur donne également accès au suivi très fin du flux sanguin, y compris dans les petits vaisseaux qui ne sont habituellement pas visibles par les examens Doppler conventionnels. « Lorsque des neurones s’activent, l’afflux sanguin à leur proximité immédiate augmente, pour leur apporter l’énergie et l’oxygène dont ils ont besoin. En permettant de visualiser ce flux sanguin en temps réel dans les capillaires cérébraux, l’échographie ultrarapide pouvait donc être utilisée pour visualiser le fonctionnement des organes, et notamment du cerveau », détaille Mickaël Tanter. En 2014-2015, dans le cadre d’Helmholtz les quatre chercheurs apportent la preuve de concept que cette technique d’imagerie fonctionnelle permet de visualiser l’activation des zones du cortex visuel et profond lors de stimulations visuelles.
Activation du cortex visuel : changer de stimulation, mais pas de cible
Devant la grande résolution des images d’activation neuronales obtenues par ultrasons dans la profondeur du cortex visuel, nos quatre scientifiques s’interrogent : « il semblait réaliste de faire l’inverse, c’est-à-dire de projeter des images ultrasonores dans le cerveau, avec une très bonne résolution spatiale », résume Serge Picaud. Avec Mickaël Tanter, ils prennent alors la décision de co-encadrer une doctorante italienne, Sara Cadoni, pour trouver un moyen de rendre les neurones du cortex sensibles aux ultrasons. Le projet SoundVision est né. La première tâche de la jeune physicienne est de trouver quelles protéines exprimables dans les neurones les rendent sensibles aux ultrasons, et plus particulièrement à la pression qu’ils peuvent appliquer, dite pression acoustique. Dans un premier temps, elle se sert de la rétine de rats comme plateforme pour faire son criblage car il est facile de visualiser dans le fond d’œil l’insertion de protéines modifiées pour porter un marqueur fluorescent.
Les résultats préliminaires s’avèrent cependant tous négatifs, aucune protéine ne semble marcher, et le moral sombre, jusqu’à la sortie, en mars 2018, d’une publication scientifique émanant de l’Institut italien de technologie situé à Gênes. Alessandro Soloperto et ses collaborateurs y décrivent leur protocole pour rendre mécanosensibles des réseaux neuronaux de mammifères grâce à l’expression dans ces neurones d’une protéine bactérienne. Cette protéine forme ce qu’on appelle un canal ionique : située à travers la membrane d'un neurone, elle permet, en réponse à un signal, l’entrée et la sortie des ions (des particules chargées) au travers de la membrane de la cellule, provoquant sa dépolarisation et donc son activation. Or, dans le cas décrit par les compatriotes de Sara Cadoni, le signal en question est la pression, et celle-ci peut être appliquée à l’aide d’ondes sonores ! La jeune doctorante tient sa protéine candidate. Et effectivement, dès les premiers essais, les résultats sont spectaculaires. Une fois son gène inséré dans un vecteur de thérapie génique et ainsi introduit dans les cellules ganglionnaires de la rétine de rats, la protéine bactérienne s’y intègre et active les neurones dans lesquels elle est présente si on les soumet à une large gamme de signaux ultrasons.


Une activation visuelle très bien résolue, dans l'espace comme dans le temps
Une fois cette validation obtenue dans la rétine, Sara Cadoni poursuit en faisant s’exprimer le canal bactérien mécanosensible dans les neurones excitateurs du cortex visuel de rats. Elle montre ainsi que, lorsqu’elle les soumet à différents signaux ultrasonores elle enregistre l’activation de ces neurones. S’ensuit tout un travail pour déterminer la fréquence d’activation optimale. Celle-ci doit permettre de cibler des zones de petite taille, y compris dans la profondeur du cortex visuel, durant assez longtemps pour activer les protéines mécanosensibles, mais en tenant compte d’une contrainte majeure : quand on augmente l’intensité acoustique d’un signal ultrasonore pour activer une protéine sonogénétique, l’énergie portée par ces ultrasons va provoquer un échauffement local. « Quand la température d’une cellule augmente au-delà d’1 ou 2°C, cela devient risqué pour sa survie » rappelle Serge Picaud, « Certaines protéines mécanosensibles sont connues pour provoquer ce type d’échauffement. Il était donc essentiel de trouver une protéine qui ne le soit pas ». En activant les neurones du cortex visuel grâce au canal bactérien caractérisé par Soloperto, les chercheurs ont montré qu’il est possible de générer des réponses neuronales de belle intensité, limitées à la zone ciblée par le rayonnement ultrasonore, et avec une augmentation très modérée de la température (moins de 0,30°C). Parce que les neurones sont activés en quelques dizaines de millisecondes après l’envoi du signal ultrasonore, et qu’ils s’inactivent aussi vite, les chercheurs ont pu obtenir de telles réponses individuelles jusqu’à une fréquence de stimulation de 13 Hertz. Soit, si ces stimulations sont effectivement susceptibles de se traduire par des images, l’équivalent de 13 images par secondes. « L’œil humain voit à environ 20 images par seconde. En distinguer 13 c’est déjà tout à fait suffisant pour la vision quotidienne », précise Mickaël Tanter.
"L’œil humain voit à environ 20 images par seconde. Si on arrive à reproduire 13 impressions visuelles par seconde, c'est déjà tout à fait suffisant pour la vision quotidienne" Mickaël Tanter
Réelle perception visuelle ? La preuve par le comportement
Mais est-ce que les souris perçoivent réellement quelque chose lors de l’activation ultrasonore de leur cortex visuel ? Pour s’en assurer, les chercheurs sont passés de l’électrophysiologique des neurones à l’échelle comportementale. Ils ont pour cela utilisé un test assez classique dit « d’apprentissage associatif ». Il s’agit d’entrainer des rongeurs, non malvoyants, à associer la vision d’un flash lumineux à l’apparition d’une récompense quelques centaines de millisecondes plus tard : ici, la mise à disposition d’eau. Au bout de quelques jours, les animaux viennent lécher le robinet en anticipation de la récompense lorsqu’ils perçoivent le signal visuel. Dans ce test, une partie des animaux avaient reçu une injection de thérapie génique visant l’expression de la protéine canal mécanosensible dans leur cortex visuel (animaux dits « transfectés ») et les autres servaient de contrôle. Tous avaient été appareillés pour qu’il soit possible d’envoyer une stimulation ultrasonore sur leur cortex visuel. Suite à la phase d’entrainement par flash lumineux, les chercheurs ont testé la réponse des animaux lors d’une stimulation directe du cortex visuel par ultrasons. La différence de réaction entre les animaux transfectés et les contrôles était significative. De plus, la vitesse de réponse des animaux transfectés s’est révélée plus rapide lors de l’activation ultrasonore, qu’en réponse au flash lumineux, ce qui semble indiquer que les souris perçoivent effectivement le même type de stimulus visuel dans les deux cas, mais que, l’activation directe du cortex visuel est plus rapide, car elle s’affranchit de la nécessité de traitement de l’information par la rétine.
"Nous avons montré que les souris ont la perception d’un flash lumineux. Si nous voulons montrer que la sonogénétique à un avenir en thérapie, il va falloir démontrer qu’on peut produire une image 3D dans le cortex visuel" Serge Picaud
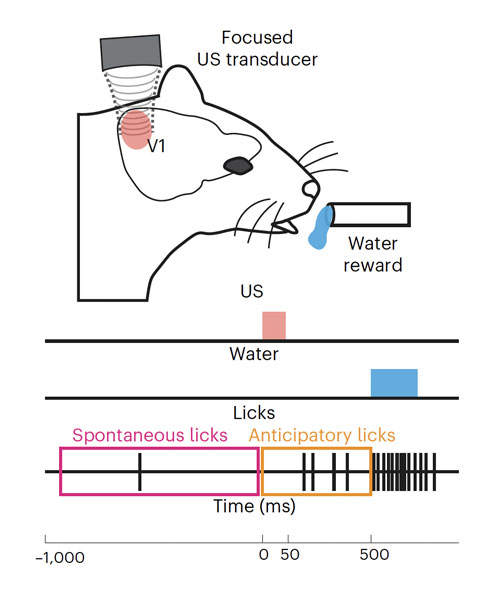
Transducteur à ultrasons focalisés
© Cadoni et al., BioRxiv
De l'activation à la vision ?
Comme le note Serge Picaud, il ne s’agit cependant encore que de la vision d’un flash lumineux. « Nous avons fait la preuve de concept de cette approche, sur le plan de l’électrophysiologie et du comportement, sur des rongeurs. Mais ce que nous avons montré c’est que les souris ont la perception d’un flash lumineux, d’un phosphène. Mais ça ce n’est pas de la vision. Si nous voulons montrer que cette approche à un avenir en thérapie, il va falloir prouver qu’elle pourrait permettre aux patients de revoir des formes. Nous devons donc démontrer qu’avec la sonogénétique on peut produire une image 3D dans le cortex visuel, y ‘imprimer’ la forme d’une lettre ». Le chercheur et ses collègues veulent pour cela passer sur un modèle animal plus proche de l’homme, le primate non-humain. Leur idée : utiliser l’imagerie ultrasonore ultrarapide pour enregistrer l’activité corticale lorsqu’ils présenteront des lettres aux animaux. Une fois que ceux-ci auront été entrainés à reconnaitre et choisir ces lettres pour obtenir une récompense, les chercheurs pourront venir stimuler les zones cérébrales identifiées lors de l’enregistrement et vérifier si le comportement appris est reproduit. Un travail plus facile à décrire qu’à faire mettent en garde les chercheurs, qui envisagent que cette phase de recherche devrait leur prendre environ cinq ans. « Il va nous falloir comprendre quels signaux il nous faut émettre pour recréer cette vision. Chez les patients, bien sûr, cela présentera un défi supplémentaire car on ne pourra pas enregistrer l’activité de leur cerveau lorsqu’ils voient, puisque leur nerf optique est endommagé. En revanche, ils pourront nous le décrire », sourit Mickaël Tanter.
La route sera encore longue avant qu’un patient au nerf optique atrophié puisse, grâce à une paire de lunettes reliées à une caméra, voir grâce à l’activation ultrasonore de son cortex visuel. Pour faire advenir cette vision, il faut concevoir la sonde ultrason adaptée, les fréquences à utiliser, les algorithmes pour la faire fonctionner, la chirurgie pour la mettre en place… et encore s’assurer de la sécurité de l’approche sonogénétique, optimiser l’utilisation du canal bactérien tout en continuant les recherches sur un canal mecanosensible humain, susceptible d’être mieux toléré par les neurones des patients et qui rendraient donc la thérapie plus sûre. Une liste de défis scientifiques à la mesure de l’ambition du projet SoundVision, et de l’envergure des équipes de recherche qui l’ont pensé.

© Alexandre Dizeux/Physics for Medicine Paris
Quid d'une activation directe du cortex visuel ?
De nombreuses équipes à travers le monde travaillent sur des pistes de restauration de la vue grâce à des matrices d’électrodes intracorticales. Pourquoi dès lors envisager de passer par la thérapie génique et les ultrasons, alors qu’il suffirait d’implanter une grille d’électrodes directement dans le cortex visuel ? Si la question est légitime, la réponse est d’une grande simplicité : le cerveau, mou, bouge à l’intérieur du crâne. Avec le temps, les mouvements du cerveau dans la boîte crânienne risquent de provoquer une fibrose cicatricielle autour des électrodes, qui va neutraliser leur effet. Un tel résultat a été constaté notamment lors d’essais chez des primates non humains. La thérapie sonogénétique a l’avantage d’être une solution « sans contact ». De plus, « les solutions avec des grilles d’électrodes intracorticales activent de l’ordre de 100 pixels, ce qui ne permet pas de distinguer la forme d’un visage, la couleur des cheveux, la présence d’un sourire… Nous pensons multiplier plus de dix fois le nombre de ces pixels », commente Mickaël Tanter avec enthousiasme. Moyennant, toutefois, la création d’une fenêtre crânienne par trépanation, afin d’installer la sonde ultrasonore dans l’os du crâne.
Propos recueillis par Aline Aurias
Soutenez la recherche, soutenez l'Institut de la Vision >
À lire aussi

Institut de la Vision : l'excellence au féminin
Nos portraits de 7 chercheuses à la pointe de l'innovation
Généticiennes, neurobiologistes, biologistes, physiciennes… : chaque jour, des chercheuses à la pointe de l’innovation font avancer la connaissance des pathologies oculaires, œuvrent au dévelo

La cataracte en 10 questions
La cataracte est une affection visuelle particulièrement courante et très bien prise en charge dans les pays dits industrialisés.

La myopie évolutive en 10 questions
Avec déjà plus de deux milliards d’individus atteints de myopie dans le monde, ce trouble de la vision continue de se répandre à travers la planète.










